Begriffe
Kalibrieren wird im Bereich der Messung von Wasserparametern für die Definition „Welches Signal des Sensors entspricht welchem Wert.“ benutzt.
Sensoren geben überwiegend ein zur Konzentration der Messgröße proportionales elektrisches Signal ab. Dieses Signal kann ein vom Hersteller definiertes oder ein Standard-Signal sein.
In elektrochemischen Prozessen sind lokale Einflussgrößen wirksam. Diese Einflüsse können das Ergebnis verfälschen. Deshalb muss diese Verfälschung überprüft und ausgeglichen werden. Dem Messgerät oder Transmitter wird beim Kalibrieren mitgeteilt, welche Größe des Signales mit welchem anzuzeigenden Wert übereinstimmen soll. Die Einstellungen erfolgen am Messgerät.
Der Sensor oder sein Signal wird nicht verändert.


Signale
Elektrische Signale kann man auf verschiedenen Wegen übermitteln:
- Als Impuls,
- als digital kodiertes Signal innerhalb eines festgelegten Protokolls,
- als Spannung und
- als Strom.
Impulse werden genutzt, um einmalige Aktionen zu beschreiben oder über die Frequenz einen fast analogen Wert zu übermitteln. Ein Beispiel ist der Impuls an eine Magnetdosierpumpe.
Einige Sensoren können bereits Signale und Werte über Modbus übertragen. Das Messgerät muss die Sprache des Bus-Protokolls verstehen.
Ein Standard-Signal ist 0 … 10V. Programmierbare Steuerungen bieten Schnittstellen für dieses Signal an.
Membranbedeckte amperometrische Sensoren nutzen das 0 … -2000mV-Signal um die Werte mit hoher Auflösung übertragen zu können.
Für die Übertragung mittels Strom wird das 4 … 20mA-Signal genutzt. Gegenüber 0 … 20mA besteht der Vorteil, dass Unterbrechungen der Verbindung erkannt werden können.
Hochohmige Messung
Redox- und pH-Sensoren benötigen keine Hilfsenergie. Der Eingang des Transmitters muss dann aber einen hohen Widerstand, meistens mehr als 1015 Ohm, bieten.


Direkte Interpretation
Redox-Sensoren: die berühmte Ausnahme
Redox-Elektroden bauen durch den Wasserstoff eine Spannung auf. Der Bereich dieser Spannung reicht von -1500 bis +1500 Millivolt. Die Spannung ermöglicht eine Aussage ob das Wasser oxidierend oder reduzierend wirkt.
Ein proportionaler Zusammenhang zur Konzentration eines Stoffes kann daraus nicht abgeleitet werden. Deshalb ist das Maß dieser Spannung der direkte Parameter. Er wird nicht in einen anderen Wert übersetzt. Die Spannung wird direkt angezeigt. Deshalb ist ein Faktor im Transmitter nicht notwendig.
Der Sensor wird nur überprüft. Dazu wird er in eine Flüssigkeit mit einer bekannten und fixierten Spannung getaucht und beide Spannungen verglichen. Diese Flüssigkeiten gibt es zum Beispiel mit +220mV oder +468mV.
Redox-Sensoren benötigen einen hochohmigen Eingang am Messgerät.

Zwei-Punkt-Kalibrierung
am Beispiel des pH-Sensors
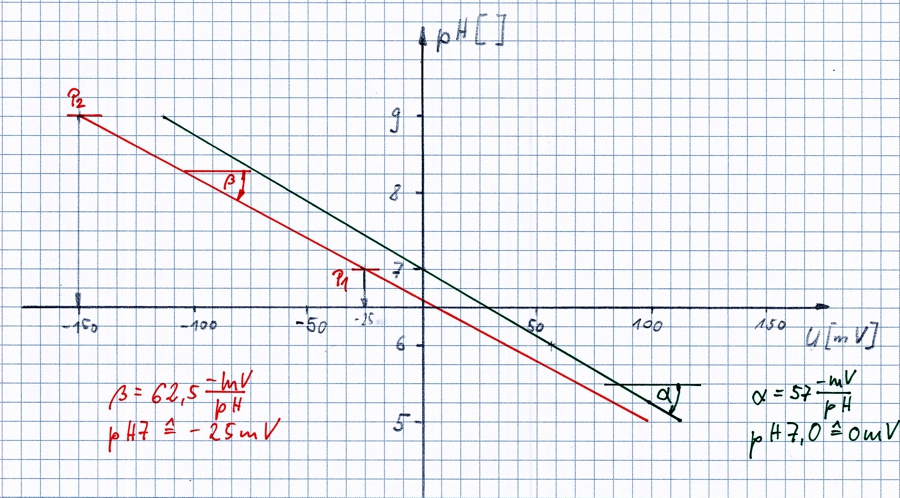
Die pH-Elektroden sind meistens so produziert, dass bei pH7,0 eine Spannung von 0mV erzeugt wird. Im neuen Zustand verändert sich die Spannung je pH-Stufe um -57mV.
In der Skizze ist dieser Zustand als schwarze Gerade mit dem Winkel α eingezeichnet. Sie befindet sich in den Punkte (pH7 / 0mV) und (pH9 / -114mV).
Die örtlichen Bedingungen und die speziellen Eigenschaften dieser Elektrode haben sich auf den Zustand der roten Linie verändert.
Zur Kalibrierung benötigt man zwei Flüssigkeiten mit fixiertem pH-Wert. Meist 7,0 und 9,0. Die saubere Elektrode wird nun in die Flüssigkeit mit pH7 getaucht. Dem Messgerät wird gesagt, die Spannung die jetzt gezeigt wird entspricht ab jetzt dem Wert pH7. Es wird ein neuer Punkt P1 berechnet. Siehe Skizze. Der gleiche Ablauf folgt für pH9 und P2.
Der Transmitter kennt ab jetzt zwei Punkte auf der Linie und kann daraus für jede Spannung den zugehörigen pH-Wert berechnen und anzeigen.
Der Transmitter muss natürlich passende Routinen für die pH-Werte besitzen. Während der Kalibrierung ist die Spülung und Trocknung der Elektrode notwendig. Abhängig vom pH-Wert und von der Temperatur verändern sich die genutzten Flüssigkeiten.
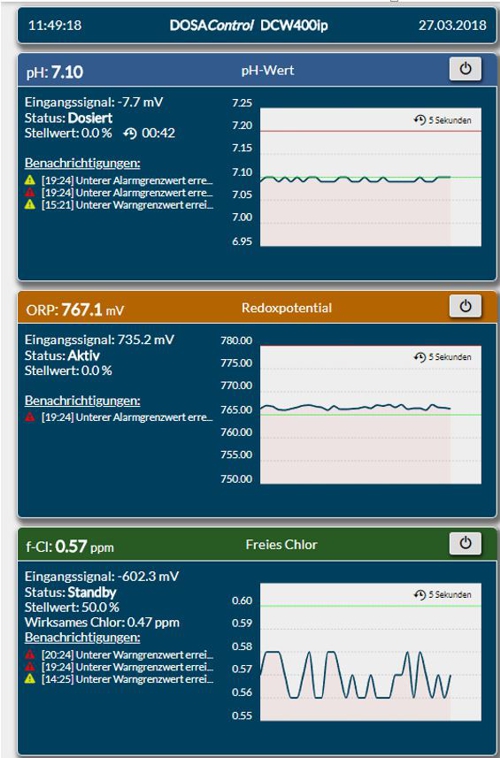
Im Mess- und Regelgerät DCW400ip wird der pH-Wert und das Signal des Sensors in Millivolt angezeigt.

Referenz-Messung
ist die Voraussetzung für eine erfolgreiche Kalibrierung
Die Referenzmessung ist dann notwendig, wenn produzierte Flüssigkeiten nicht geeignet sind. Dies kann sein, weil die Flüssigkeit nicht lagerfähig ist, oder weil der Transport nicht erlaubt ist. Man muss eine Flüssigkeit vor Ort nutzen und zum Vergleich ausmessen.
Als Beispiel wird die Messung von Freiem Chlor genutzt. Die übliche Methode zur Messung ist die DPD-Messsung mittels eines Photometers. Am Photometer wird abhängig vom Hersteller des Gerätes und der Chemikalien ein Messbereich genannt. Der Messbereich beginnt etwa bei 0,05mg/l und endet im Beispiel bei 5,0mg/l. In einigen Fällen ist eine Auflösung angegeben, die aber ein technischer Parameter ist.
Der größte Fehler ist es, diese Auflösung mit der Genauigkeit der Messung gleich zu setzen. Die Genauigkeit wird durch den Nutzer definiert.
Dies kann und sollte überprüft werden. Ein Benutzer soll hintereinander 10 mal vollständig die gleiche Probe mit etwa 1,0mg/l vermessen. Was ist der Mittelwert und wie groß ist der Bereich. Vermutlich wird ±0,1 … ±0,2mg/l erreicht werden. Dies ist die Genauigkeit der Messung! Diese Genauigkeit ist unabhängig davon, ob bei 10,00 oder 5,00 oder 1,00 oder 0,5mg/l durchgeführt wurde.
Der gleiche Versuch sollte noch mit einem zweiten Nutzer ausgeführt werden. Wie groß ist der zweite Mittelwert vom ersten Mittelwert entfernt? Der Abstand der Mittelwerte repräsentiert den individuellen Fehler der Nutzer.
Ein reales Beispiel für Peter und Georg hatte das Ergebnis:
- Peter Mittelwert 0,92mg/l, obere Abweichung 0,10mg/l, untere Abweichung -0,11mg/l,
- Georg: Mittelwert 1,06mg/l, obere Abweichung 0,15mg/l, untere Abweichung 0,09mg/l
Besonders bei sehr kleinen Sollwerten für die Konzentration muss dieser Zusammenhang als Fehlerbetrachtung in der Ein-Punkt-Kalibrierung beachtet werden.
Der Zusammenhang zwischen Freiem Chlor, dem pH-Wert und der DPD-Messung ist ein Thema im Tutorial zu Chlor.
Bedingungen für 1-Punkt-Kalibrierung
müssen zuvor sichergestellt werden.
Als Beispiel wird weiter die Messung von Freiem Chlor mittels membran-bedecktem Sensor der Marke DOSASens genutzt.
Der Name „1-Punkt-Kalibrierung“ ist falsch! Denn auch diese Methode nutzt 2 Punkte. Aber weil ein Punkt immer im Ursprung des Diagramms sitzt, wird nur über den anderen Punkt diskutiert.
Damit ist die erste wichtige Information gegeben:
- Der Kalibrier-Punkt darf nicht im Nullpunkt liegen!
- Der Kalibrier-Punkt muss maximal entfernt vom Nullpunkt liegen!
Was wird dafür benötigt?
- Der Sensor muss im System in die Anlage gebaut sein.
- Der Sensor muss mit entsprechend seinem Datenblatt mit Spannung versorgt werden.
- Der Sensor muss ein Signal ausgeben. Dazu muss die Messgröße nahe der Obergrenze des Messbereiches sein.
- Der Sensor muss ausreichende Zeit der Inbetriebnahme.
- Die Messgröße muss stabil sein.
- Die Flüssigkeit darf keine Gasblasen bilden.
- Der Volumenstrom zum Sensor muss stabil sein.
- Eine Ventil zur Entnahme
- Der Transmitter muss ein Signal empfangen und optimal auch anzeigen.
- Ein Gerät zur Referenzmessung muss vorhanden sein.
Speziell für das Beispiel muss der Membran-bedeckte Sensor gilt:
- mit dem zulässigen Druck,
- durch eine 6mm Öffnung im Abstand von 15mm,
- mit 30 Liter pro Stunde angeströmt werden.
Im Foto wird einen Armatur dargestellt, die diese Bedingungen erfüllt und überwacht.

1-Punkt-Kalibrierung
Wenn alle Bedingungen aus Blatt 06 erfüllt sind, dann ist es ein kurzer Ablauf!
Es empfiehlt sich, eine Checkliste für die Bedingungen und ein Protokoll-Buch für die Ergebnisse der Kalibrierung zu nutzen. Eventuell ist das Messgerät mit diesen Funktionen ausgestattet. Als Beispiel wird weiter die Messung von Freiem Chlor mittels membran-bedecktem Sensor der Marke DOSASens mit einem Signal 0 … -2000mV genutzt.
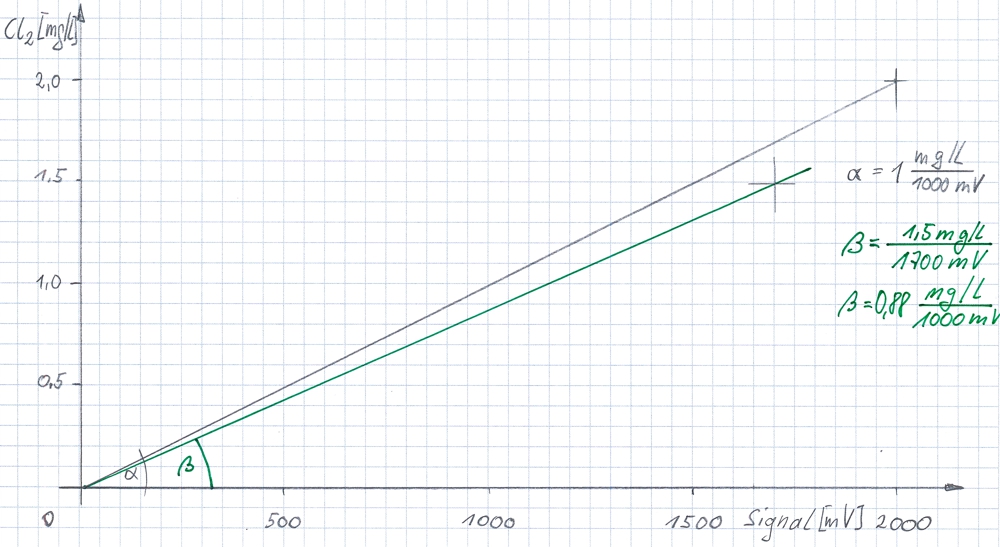
Das skizzierte Diagramm zeigt die Berechnung im Transmitter. Der Sensor sollte bei 2,0mg/l Chlor im Wasser ein Signal von -2000mV senden. Das Verhältnis beider Werte ist die theoretische Steigung des Sensors (α). Die gespeicherte Steigung ermöglicht dem Messgerät das aktuelle Signal in einen Messwert mit Einheit umzurechnen.
Die aktuelle Steigung des Sensors ist aber von anderen Parametern im Wasser und der Umgebung abhängig. Deshalb muss jeder Sensor nach einer fixierten Zeit kontrolliert und kalibriert werden. Im Beispiel hat sich die Steigung reduziert. Per Referenz-Messung wird ermittelt, dass bei einem Signal von 1700mV die Konzentration 1,5mg/l Chlor ist (grüne Linien, Steigung β). Dies muss dem Transmitter gesagt werden, damit der Transmitter die Zwischenwerte auf der grünen Linie berechnet.
Vorbereitung:
- 3 Küvetten säubern und trocknen. Wenn weniger Küvetten vorhanden sind, dann ein Gefäß mit mindestens 100 Millilitern bereitstellen, säubern und trocknen.
- Das Photometer öffnen und aktivieren.
- Am Photometer die korrekte Mess-Methode kontrollieren und einstellen.
- Die notwendigen Reagenzien für diese Methode kontrollieren und bereitstellen. Dies sollte man natürlich nicht erst nach einer Anreise tun.
- Die Funktion des Ventiles zur Entnahme der Probe prüfen und wieder schließen.
- Die Funktion der Kalibrierung am Transmitter in Erinnerung rufen. Eventuell kann eine Entsperrung des Transmitters mit einem Passwort notwendig sein.
- Transmitter entsperren.
Durchführung:
- Den aktuellen Messwert (in mg/l) und das aktuelle Signal des Sensors (in mV) notieren. Abhängig vom Gerät kann dies nur möglich sein, wenn die Methode zur Kalibrierung gestartet wurde.
- Am Ventil die Probe in mindestens 3 Küvetten oder das größere Gefäß entnehmen. Durch die Veränderung des Volumenstromes wird sich das Signal des Sensors verändern. Deshalb ist es wichtig, alle Proben gleichzeitig und sehr schnell nach der Notiz des aktuellen Signals zu entnehmen.
- Mit der ersten Küvette den Null-Test durchführen. (alle Schritte nach Bedienungsanleitung des Photometers)
- Die Reagenzien in die ersten Küvette geben.
- Den Test der ersten Küvette ausführen.
- Den gemessenen und angezeigten Wert notieren.
- Alle Schritte mindestens 2 mal in kurzer Zeit mit der gleichen Probe wiederholen.
- Den Mittelwert aus den Werten des Photometers berechnen. Diesen Wert auf Plausibilität prüfen. Ist der Wert erfahrungsgemäß korrekt?
- Die Übereinstimmung des aktuellen Signals des Sensors mit dem zuvor notierten Signal prüfen. Besonders bei unstabilen Prozessen kann es zu Veränderungen gekommen sein. Wenn keine Übereinstimmung dann siehe den Abschnitt Hilfe bei der Korrektur.
- Den Mittelwert in den Transmitter eingeben und bestätigen.
- Damit ist die Kalibrierung in der Regel abgeschlossen. Der Transmitter berechnet Werte nun anhand der neuen Steigung.
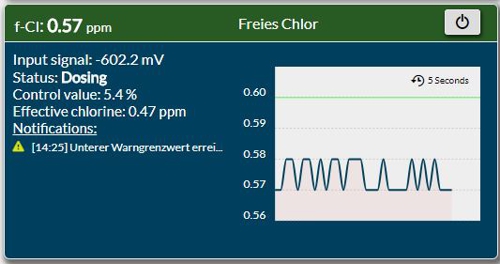


Nacharbeiten:
- Wenn kein Signal oder ein zu niedriges Signal vom Sensor während der Bestätigung vorhanden war, dann müssen einige Transmitter in den Werkszustand zurück versetzt werden. Eine Division durch Null ist besonders bei alten Transmittern tödlich. Total-Reset!
- Wenn kein Messwert während der Bestätigung vorhanden war, dann müssen einige Transmitter in den Werkszustand zurück versetzt werden. Total-Reset!
- Notieren Sie den eingetragenen Mittelwert, das Signal des Sensors bei Eintragung und berechnen Sie die Steigung für diese Werte.
- Wenn die praktische Steigung kleiner wird als 50% der theoretischen Steigung dann planen Sie den Austausch des Sensors.
- Notieren Sie die verbleibende Zeit bis zur nächsten planmäßigen Wartung des Sensors.
Hilfe zur Berechnung:
Wenn sich das Signal seit der Entnahme der Probe verändert hat, dann berechnen sollten Sie den Mittelwert vor der Eingabe in das Messgerät korrigieren.
Wert zur Eingaben = Mittelwert x (Signal bei Eingabe / Signal bei Entnahme der Probe)
Fehler in der 1-Punkt-Kalibrierung
Die Sensoren und die Messgeräte sind nur so genau wie der Nutzer!
Aus den Erläuterungen zur Referenz-Messung ist bekannt, dass durch den Nutzer des Photometers ein Fehler von etwa ±0,1mg/l entsteht. Als Beispiel wird weiter die Messung von Freiem Chlor mittels membran-bedecktem Sensor der Marke DOSASens mit einem Signal 0 … -2000mV genutzt.
Wenn noch nicht geschehen, dann testen Sie sich selbst und das Photometer durch Wiederholung der Messung an einer Probe. Siehe Blatt 05 zur Referenz-Messung.
Der Fehler bei der Messung mit dem Photometer ist unabhängig vom Bereich, in dem gemessen wird. Er wirkt sich aber auf die Kalibrierung aus.
Bester Fall:
Wenn man zum Zeitpunkt der Kalibrierung eine realen Konzentration von 2,0mg/l hat, dann kann der gemessene Mittelwert im Bereich zwischen 1,9mg/l und 2,1mg/l sein. Die Kalibrierung würde den realen Wert mit einem maximalen Fehler von 5% berechnen und anzeigen.
Das skizzierte Diagramm zeigt den Fall für unser voriges Beispiel mit langen roten Linien zum Punkt 1,5mg/l mit -1700mV.
Wenn man bei 2,0mg/l kalibriert, dann hat man im Bereich 0,5mg/l die relative Sicherheit, zwischen 0,525mg/l oder 4,975mg/l zu sein.
Mittlerer Fall:
Wenn man zum Zeitpunkt der Kalibrierung eine realen Konzentration von 1,0mg/l hat, dann kann der gemessene Mittelwert im Bereich zwischen 0,9mg/l und 1,1mg/l sein. Die Kalibrierung würde den realen Wert mit einem maximalen Fehler von 10% berechnen und anzeigen.
Das skizzierte Diagramm zeigt diesen Fall mit einer Verlängerung von roten Linien zum Punkt 1,5mg/l mit -1700mV.
Schlechtester Fall:
Wenn man zum Zeitpunkt der Kalibrierung eine realen Konzentration von 0,5mg/l hat, dann kann der gemessene Mittelwert im Bereich zwischen 0,4mg/l und 0,6mg/l sein. Die Kalibrierung würde den realen Wert mit einem maximalen Fehler von 20% berechnen und anzeigen.
Das skizzierte Diagramm zeigt diesen Fall mit einer Verlängerung von roten Linien zum Punkt 1,5mg/l mit -1700mV. Hier erkennt man den Abstand der Verlängerung auf den Punkt. Wenn man bei 0,5mg/l kalibriert, dann hat man im Bereich 1,5mg/l die releative Sicherheit zwischen 1,8mg/l oder 1,2mg/l zu sein.


Unmöglicher Fall:
Wenn man zum Zeitpunkt der Kalibrierung eine realen Konzentration von 0,1mg/l hat, dann kann der gemessene Mittelwert im Bereich zwischen 0,0mg/l und 0,2mg/l sein. Die Kalibrierung würde den realen Wert mit einem maximalen Fehler von 100% berechnen und anzeigen. In der Praxis wäre die Unsicherheit zwischen 0,0mg/l und 0,2mg/l.
Das skizzierte Diagramm zeigt diesen Fall mit einer Verlängerung der oberen roten Linie. Der Punkt 1,5mg/l mit -1700mV kann nicht erreicht werden. Der eingeschlossene Bereich zwischen dieser Linie und 0,0mg/l ist so groß, dass keine Anzeige eines realistischen Wertes möglich ist.
Abhilfe:
- Es ist möglich den individuellen Fehler am Messgerät zu verringern, in dem die Anzahl der Messungen erhöht wird. Der Mittelwert wird korrekter.
- Man kann für den Zeitpunkt der Kalibrierung die reale Konzentration im Wasser erhöhen. Die Linearität des Sensors besteht auch in der Nähe des Nullpunktes. Dies kann man nutzen.
- Wenn die geregelte Anlage keine Erhöhung der Konzentration erlaubt, zum Beispiel bei der Messung von Ozon, dann kann für die Kalibrierung ein zweiter kleiner Kreislauf mit separatem Behälter genutzt werden.
- Einige Transmitter lassen sich ohne Reset aus einer falschen Kalibrierung „retten“, wenn man ein künstliches Signal verbindet und dazu einen logischen Wert kalibriert. Zum Beispiel -1200mV aus einer korrekt gepolten Batterie und 1,2mg/l.
Null-Punkt-Kalibrierung
Die Null-Punkt-Kalibrierung ist nicht erforderlich!
Membran-bedeckte Sensoren der Marke DOSASens und andere deutsche Fabrikate besitzen einen elektronischen Null-Punkt-Abgleich. Dies bedeutet, dass bei 0,00mg/l genau 0mV oder genau 4,00mA ausgegeben werden.
Der Transmitter:
Die Auswertung einer Spannung bezüglich 0mV oder 4,00mA ist nicht einfach. Die Bauteil-Toleranzen, Temperaturen oder Luftfeuchtigkeit können den Messwert des Transmitters im wenige Millivolt oder einige µA verschieben. Qualitativ hochwertige Fabrikate erreichen die in der DIN IEC 60381 Teil 1 und 2 beschriebenen Toleranzen.
Das häufigste Missverständnis:
Das häufigste Missverständnis betrifft wieder den Transmitter. Wenn kein Sensor angeschlossen ist, bedeutet das nicht, dass 0mV oder 4,00mA empfangen werden. Der Fehler, dass eine offene Stromschleife 0,00mA transportiert, wird in der Regel schnell erkannt. Aber der Fehler, dass offene Kontakte immer irgendeinen aber selten einen Null-Wert für Millivolt liefern, kann Kopfschmerzen erzeugen.
Abhilfe für das mA-Signal:
Wenn man hier trotzdem einen Fehler vermutet, dann muss man einen sehr hochwertigen Simulator für das mA-Signal mit dem Transmitter verbinden. Abweichungen von ±5µA sind nach Norm erlaubt. Der Simulator sollte also mit einer Genauigkeit von ±1µA arbeiten. Wenn die Abweichung von 5µA festgestellt wurde, dann kann der Transmitter beim Hersteller reklamiert werden. Das Prüfprotokoll des Simulators sollte der Reklamation beigefügt werden.
Abhilfe für das mV-Signal:
Die Kontrolle des Null-Punktes ist hier einfacher. Es ist nur notwendig, die beiden Pole für das Signal am Eingang elektrisch leitend miteinander zu verbinden. Dieser Ausgleich der Potenziale ergibt 0mV, die im Transmitter angezeigt werden sollten. Es ist zu empfehlen, das Kabel zwischen Sensor und Transmitter in diesen Test einzubeziehen.
Hochwertige Transmitter verfügen über die Möglichkeit, geringe Fehler durch Einflüsse der Umgebung und des Kabels auszugleichen. Sie verfügen ausschließlich für diesen Zweck über eine „Null-Punkt-Kalibrierung“.
Achtung, diese Methode darf nicht auf einen mA-Eingang angewendet werden! Die elektrische Verbindung könnte die Hardware zerstören.


Prozess-Verständnis
ist die Voraussetzung für eine erfolgreiche Kalibrierung!
Kalibrieren bedeutet in erster Linie „vergleichen“! Nicht Äpfel mit Birnen sondern ein Signal mit einem zweiten Signal!
Einfach ist es, wenn man eine Referenz-Flüssigkeit mit vorher eingestellter Konzentration nutzen kann. Diese Flüssigkeit muss natürlich lange haltbar und erhältlich sein. Beispiele sind Puffer-Flüssigkeiten für den pH-Wert oder den Redox-Wert. Auch für Ionenselektive Elektroden wird diese Methode häufig genutzt.
Eine zweite Möglichkeit ist es, die Konzentration mit einem zweiten Mess-Verfahren festzustellen. Für Freies Chlor wird dazu in der Regel die DPD-Methode genutzt.
Die Chemie auf der Prozess-Seite verstehen.
Wenn Freies Chlor in Wasser gegeben wird, dann mit der Absicht, zu desinfizieren. Wenn im Wasser gelöstes Eisen oder Mangan vorhanden ist, dann werden diese Stoffe zuerst oxidiert und die Desinfektion muss warten. Keine Messung wird freies Chlor zeigen, obwohl es vorhanden war.
Wenn Freies Chlor in Wasser mit Pflanzen-Dünger gegeben wird, dann geht es sofort mit dem vorhandenen Ammonium in eine (stark riechende) Verbindung. Der membran-bedeckte Sensor wird kein Freies Chlor melden obwohl es die Nase suggeriert. Die DPD-Messung wird bei schneller Ausführung kein Freies Chlor zeigen, was sich aber schon nach etwa einer Minute zu einem Fehler hin verändert.
Wenn Freies Chlor in Wasser mit sehr hohem pH-Wert gegeben wird, dann dissoziiert das Chlor zum Ion OCl-. Die DPD-Messung wird feststellen, dass Freies Chlor vorhanden ist obwohl keine Wirkung zu erkennen ist.

Die Chemie auf der Referenz-Seite verstehen.
Denn die DPD-Messung verändert mit der ersten Supstanz den pH-Wert der Probe, so dass das Ion in die Hypochlorige Säure verwandelt wird. Die DPD-Methode misst nicht das Freie Chlor sondern die oxidative Wirkung der Unterchlorige Säure auf den Farbstoff N-diethyl-p-phenylenediamin. Ein guter membran-bedeckte Sensor hingegen misst über einen breiten pH-Bereich mit geringer Abhängigkeit das Freie Chlor direkt. Die pH-Bewegung kann in einem passenden Regler kompensiert werden. Siehe Innovative Produkte DCW 400ip. Alle Wechselbeziehungen sind nicht darstellbar, aber folgendes Beispiel sollte das System erläutern.
Meerwasser mit Chlor-Desinfektion
Ist echtes Meerwasser im Pool und man fügt Chlor zur Desinfektion hinzu, dann geschieht folgendes:
Wie Chlor kommt auch Brom in der Natur nur in der gebundenen Form als Bromid zum Beispiel als AgBr vor. In Meerwasser ist etwa 68mg/l als Br- vorhanden. Brom ist weniger reaktionsfähig als Chlor. Deshalb ist Chlor in der Lage, das Brom aus den Verbindungen zu verdrängen. Gibt man also Freies Chlor in das Meerwasser wird das Chlor in Chloriden (Salzen) gebunden und gleichzeitig wird Brom frei. Die Desinfektion wird vom Brom übernommen. Ein Pool-fremdes Beispiel der Reaktion:
2KBr + Cl2 → 2KCl + Br2
Der Platz-Tausch Chlor und Brom bleibt der DPD-Messung unbekannt, denn es wird für Chlor und Brom die gleiche Methode und der gleiche Farbstoff N-diethyl-p-phenylenediamin genutzt. Wenn man die Methode „Chlor“ einstellt, ist am Photometer trotzdem ein Wert für Brom zu sehen. Wenn man an der Uhr die Zeit verstellt, befindet man sich trotzdem am gleichen Platz auf der Erdoberfläche.
Ein guter membran-bedeckter Sensor unterscheidet Brom und Chlor. Wird im Beispiel ein Chlor-Sensor eingesetzt findet dieser Sensor keine Konzentration, denn es ist kein Freies Chlor vorhanden. Es ist also wichtig zu wissen, dass man nur mit einem Brom-Sensor die Konzentration des Desinfektionsmittels feststellen kann.

Meerwasser mit Ozon-Desinfektion
Auch beim Ozon-Verfahren müssen unerwünschte Nebenprodukte berücksichtigt werden. Die Bromide des Meerwassers reagieren in erster Stufe zu Hypobromiger Säure:
Br– + O3 → HOBr
Nun könnte man vermuten, es funktioniert wie beim Chlor. Aber in einem zweiten Schritt wird die Unterbromige Säure weiter zum Bromat oxidiert. (Dieses Bromat ist giftig und unterliegt nationalen Grenzwerten im Trinkwasser.) Der Prozess lässt sich quantitativ sehr schwer berechnen.
HOBr + O3 → BrO3–
Stellt sich die Frage, wo ist das Ozon? In der Unterbromige Säure oder im Bromat? Vielleicht hat die Hypobromige Säure bereits mit dem Ammonium reagiert und liegt als Gebundenes Brom (vergleichbar mit Gebundenem Chlor) vor.
Oder hat das Ozon bereits mit dem den Chloriden zu HOCl reagiert?
Im Meerwasser ist aber auch Jodid, etwa 0,5mg/l. Das Ozon reagiert auch mit dem Jodid im ersten Schritt zu Hypoiodiger Säure HIO.
Ist das Ozon im Jod gebunden? Wer hat die Lotterie gewonnen? Dieses chemische Wissen muss vor dem Einsatz von Ozon bekannt sein. Weder ist es durch eine DPD-Methode noch durch einen membran-bedeckten Sensor für Ozon zu ersetzen.
Wenn kein Ozon im Wasser vorhanden ist, dann kann und soll ein membran-bedeckter Sensor kein Ozon anzeigen! Die Aussage „für Meerwasser geeignet“ bedeutet nicht, dass die chemischen Zusammenhänge außer Kraft gesetzt werden können. Es bedeutet nur, dass der Sensor nicht vom Salz des Wassers zerstört wird.

Wenn die DPD-Methode als Referenz eingesetzt werden soll, dann wird der Iodid-Prozess ausgenutzt. Der Wasser-Probe wird Kaliumiodid zugesetzt. Vorhandenes Ozon bildet Hypoiodige Säure. Die Hypoiodige Säure wirkt auf den Farbstoff N-diethyl-p-phenylenediamin.
Gebundenes Chlor und gebundenes Brom wirken aber ähnlich auf Kaliumiodid und bilden Hypoiodige Säure. Die 3 Quellen Brom, Chlor und Ozon bilden also am Ende Hypoiodige Säure. Wieviel davon dem Ozon zugerechnet werden kann, ist nicht berechenbar.
In diesem Fall zeigt die DPD-Methode über das Photometer „irgendeine“ Ursache für die Hypoiodige Säure plus der hypochlorigen und der hypobromigen Säure an. Mit höchster Wahrscheinlichkeit ist kein Ozon in der Probe vorhanden.
Ein guter membran-bedeckter Sensor zeigt NUR das Ozon in der Probe. Obwohl man Ozon dosiert ist es bereits nach wenigen Millisekunden kein Ozon vorhanden. Der Sensor wird nichts anzeigen! Sind diese Zusammenhänge nicht bekannt, wird der Fehler beim Sensor und nicht bei der chemischen Unwissenheit des Prozesses gesucht.
Für die DPD-Methode könnte ersatzweise die Indigo-Trisulfat-Methode bessere Ergebnisse für die Konzentration von freiem Ozon zeigen. Auf der Sensor-Seite kann man versuchen, die Desinfektionswirkung über einen Brom-Sensor zu erkennen.











Schreibe einen Kommentar
Du musst angemeldet sein, um einen Kommentar abzugeben.